Weiße und gelbe Luftballons, goldene Sternengirlanden und Lichterketten schmücken den Festsaal im Dachgeschoß. Kaan Boztug ist sichtlich zufrieden an diesem verschneiten Dezemberabend. In wenigen Stunden wird der wissenschaftliche Direktor mit Kolleginnen und Kollegen auf das 35-jährige Bestehen der St.-Anna-Kinderkrebsforschung (CCRI) anstoßen.
Österreichs ausschließlich spendenfinanziertes Vorzeigeprojekt, angesiedelt im neunten Wiener Gemeindebezirk, hat einen langen Weg hinter sich, der steinig und erfolgreich zugleich war. Als das Zentrum 1988 seine Arbeit aufnahm, lagen die Überlebenschancen krebskranker Kinder bei 20 Prozent. Durch interdisziplinäre und internationale Forschungsarbeit und die Kooperation von Forschenden und Praktikerinnen hat das CCRI mitgeholfen, dieses Verhältnis zu ändern.
Kinderkrebs ist anders
Heute überleben 80 Prozent der an Krebs erkrankten Kinder. Ein Paradebeispiel dafür, wie Forschung in der Medizin enorme Fortschritte ermöglichen könne. "Wir möchten jeden Tag ein bisschen besser sein als am Tag davor und werden weiter nach den Sternen greifen", sagt Boztug. Am CCRI hat man große Visionen: Krebs bei Kindern soll künftig so weit wie möglich verhindert werden. "Wo das nicht gelingt, wollen wir die Erkrankung und etwaige Rückfälle so früh wie möglich erkennen und schneller, effizienter und weniger toxisch behandeln."
In Österreich erkranken jedes Jahr etwa 200 Kinder und etwa 100 Jugendliche an Krebs. Viele Tumoren, die bei Kindern auftreten, existieren bei Erwachsenen nicht oder präsentieren sich biologisch und genetisch gänzlich unterschiedlich. Dieser Umstand unterstreiche, weshalb ein eigenes Institut für die Erforschung von Kinderkrebs so bedeutend sei, betont Boztug. Da die Überlebenswahrscheinlichkeit bis dato stark zugenommen hat, gewinnen die möglichst schonende Behandlung und die Optimierung der Nachsorge stärker an Bedeutung.
15 Forschungsgruppen und rund 250 Mitarbeitende widmen sich dabei Themen wie Genetik, Präzisionsmedizin, Krebsprädisposition und -genomik. Seit 2018 leitete Sabine Taschner-Mandl die Gruppe Tumor Biology. "Wir haben einen Schwerpunkt auf soliden Tumoren, das sind oft Arten mit schlechten Überlebenschancen", sagt die Wissenschafterin. Ein spezieller Fokus liegt auf dem Neuroblastom. Dieser bösartige Tumor des peripheren Nervensystems betrifft vor allem Kinder im Vorschulalter – etwa 1500 Fälle sind es jährlich in der EU.
Diagnose mittels Blutprobe
Rund fünf Prozent dieser Tumoren sind Hochrisikofälle, es treten häufig Rezidive auf, bei denen Tumoren nach einer Behandlung wieder auftreten und herkömmliche Therapien nicht mehr wirken. Mit ihrem Team geht Taschner-Mandl ungelösten Fragen zur Pathogenese von Neuroblastomen nach und entwickelt neue diagnostische und therapeutische Ansätze, um die Präzisionsmedizin für Kinder mit bösartigen Tumoren zu verbessern.

Neue Türen soll die Flüssigbiopsie öffnen. Bei dieser Methode können selbst geringe Mengen von Tumor-DNA im Blut von Patientinnen und Patienten nachgewiesen werden. Sogar Mutationen sind damit belegbar. Fachleute können dadurch die Aggressivität der vorliegenden Tumorart einschätzen und die geeignetsten therapeutische Maßnahmen wählen. Die Flüssigbiopsie soll daneben die Diagnose bei jungen Betroffenen erleichtern und invasive Eingriffe möglichst ersetzen. Gerade Kinder sind manchmal schon derart geschwächt, dass eine herkömmliche Biopsie gar nicht möglich ist. Wenn bildgebende Verfahren nötig sind, ist bei Kleinkindern eine Anästhesie zudem oft unumgänglich. Mit der Flüssigbiopsie soll auch das verhindert werden.
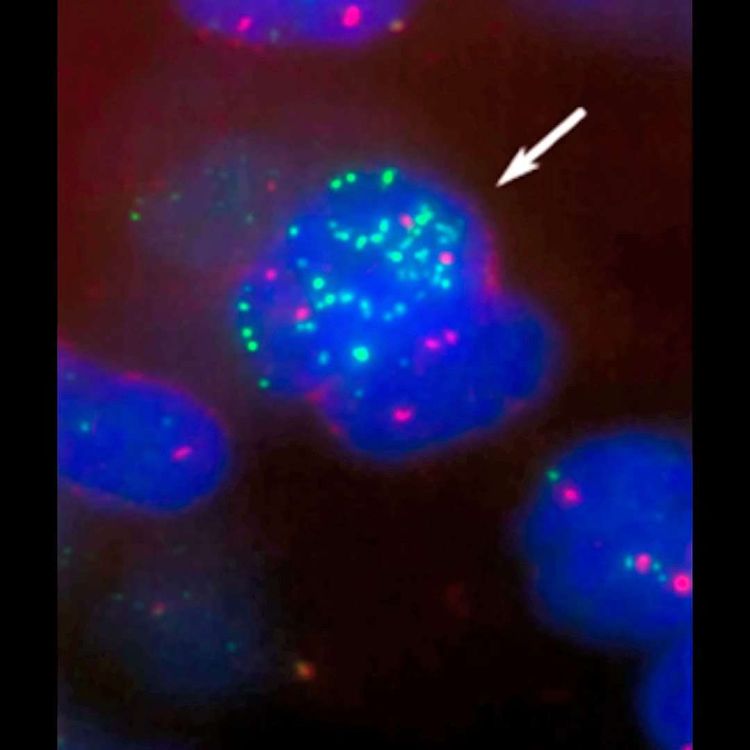
Neben dem hellerleuchteten Labor geht es ins dunkle Kämmerchen. An Proben von Patientinnen und Patienten aus ganz Österreich werden hier diagnostische Tests durchgeführt. "Wir sitzen immer im Finsteren", scherzt Marie Bernkopf, während am Bildschirm vor ihr laufend Zellkerne als verschwommene blaue Kreise auftauchen. Aus diesen zigfach vergrößerten Aufnahmen lässt sich einiges ablesen: Durch Mikroskopieverfahren können die Mikrobiologin und ihr Team nicht nur Tumorzellen erkennen, sondern auch nachweisen, ob eine Metastasenbildung vorliegt. Bernkopf, die das Team für pädiatrische solide Tumordiagnostik leitet, ist in translationalen Forschungsprojekten engagiert, so auch im geteilten Labor mit Taschner-Mandl.

Ziel ist es, neue Techniken und Ansätze in die Diagnostik zu übertragen, um die Risikostratifizierung und das Überleben junger Betroffener zu verbessern. Neben der Verknüpfung von Grundlagenforschung und klinischer Praxis spielt in der Kinderkrebsforschung angesichts geringer Fallzahlen die internationale Zusammenarbeit eine tragende Rolle. Um in Studien eine statistische Signifikanz zu erreichen, braucht es eine gewisse Datenmenge. Weltweit stehen Forschungszentren daher in konstantem Austausch miteinander.
Die Lunge im Mittelpunkt
Im Labor von Branka Radic-Sarikas und Heinrich Kovar liegt der Fokus auf dem Ewing-Sarkom, ein bösartiger Knochenkrebs. In Österreich betrifft der aggressive Tumor fünf bis acht Kinder pro Jahr, die langfristige Überlebensrate liegt bei nur 50 bis 60 Prozent. Der Großteil der Betroffenen sterbe an Metastasen, erläutert Gruppenleiter Kovar. "90 Prozent aller assoziierten Todesfälle treten durch die Metastasierung der Krankheit auf." Interessanterweise wandern diese verstärkt in ein Organ: die Lunge. Warum das so ist, ist unklar.

In der Theorie existieren Ideen und Ansätze, für deren Erprobung bisher geeignete Modelle fehlten. Mäuse als Modellorganismen haben die Forschung zwar vorangetrieben. Dennoch unterscheiden sich die Tiere genetisch stark vom Menschen. Es braucht also Alternativen, um Diagnose- und Behandlungswege zu testen und das Verständnis der Tumorentwicklung auszubauen. Als vielversprechender Ansatz haben sich Organoide erwiesen.

Tumor-Kommunikation
Diese Zellgruppen bilden die Strukturen von Organen nach und haben als eine Art Crashtest-Dummy den Vorteil, dass sie auf Zellmaterial der jeweiligen Patientin oder des Patienten basieren. Sichtlich begeistert zeigt Radic-Sarikas auf die kleinen, kreisrunden Lungenorganoide auf dem Bildschirm. Diese vereint die studierte Pharmazeutin mit Knochentumorzellen, um zu sehen, was passiert, und um herauszufinden, warum das Sarkom meist in die Lunge metastasiert.
Die Organoide lassen sich auch für das Testen neuer Therapiewege nutzen. "Basierend auf Patientenzellen erstellen wir Modelle, können Medikamente daran testen, aber auch Metastase-Prozesse besser verstehen", erklärt Kovar.

Knifflig ist das Unterfangen, da Kinderkrebszellen extrem anpassungsfähig sein können. Erstaunlich ist, dass sie aus dem sehr sauerstoffarmen Milieu der Knochen vorwiegend in das sauerstoffreiche Milieu der Lunge metastasieren – was die komplette Umstellung etlicher Zellmechanismen erfordert.
Ein Ziel der Forschenden ist es, die Kommunikationswege zwischen Lungen- und Tumorzellen zu identifizieren, die der Tumor nutzt, um sich in der Lunge anzusiedeln. Ließen sich Muster erkennen und Kommunikationswege pharmakologisch blockieren, könnten sich neue therapeutische Pfade zur Bekämpfung von Metastasenbildung auftun – und das könnte einen weiteren Griff nach den Sternen bedeuten. (Marlene Erhart, 27.12.2023)