Fast eine halbe Million Menschen stirbt jährlich an Malaria – zum größten Teil Kinder. Seit Jahrzehnten wird intensiv an der Entwicklung von Impfstoffen geforscht, der große Durchbruch ist bisher allerdings ausgeblieben. Wissenschafter verfolgen daher auch ganz andere Strategien im Kampf gegen die tückische, von Moskitos übertragene Infektionskrankheit.
Bild nicht mehr verfügbar.
Eine davon hat in den vergangenen Jahren gehörigen Auftrieb bekommen, gleichzeitig aber auch heftige Kontroversen ausgelöst. Kein Wunder, geht es dabei doch um nicht weniger als einen beispiellosen Eingriff in die Natur: Mithilfe neuer molekularbiologischer Werkzeuge wird versuchsweise daran gearbeitet, den surrenden Malaria-Überträgern den Garaus zu machen – und zwar endgültig. Manipulationen mit sogenannten Gene-Drives (auf Deutsch Genantriebe) könnten es ermöglich, einzelne Moskitoarten stark zu dezimieren oder sogar vollständig auszurotten. Das könnte auch bei Überträgern anderer gefährlicher Krankheiten wie Dengue-Fieber oder Zika-Fieber funktionieren.
Schummler im Erbgut
"Im Grunde erlauben es Gene-Drives, Gene in einer ganzen Population zu verbreiten", sagt Alejandro Burga, Gruppenleiter am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften (ÖAW) in Wien. "Wenn ein Nachkomme gezeugt wird, gibt es eine 50-prozentige Wahrscheinlichkeit, ob ein Gen von der Mutter oder vom Vater vererbt wird, zumindest trifft das auf die meisten Erbanlagen zu. Heute wissen wir aber, dass es Teile in der DNA gibt, die 'schummeln' und dadurch ihre Chancen, weitervererbt zu werden, erhöhen."
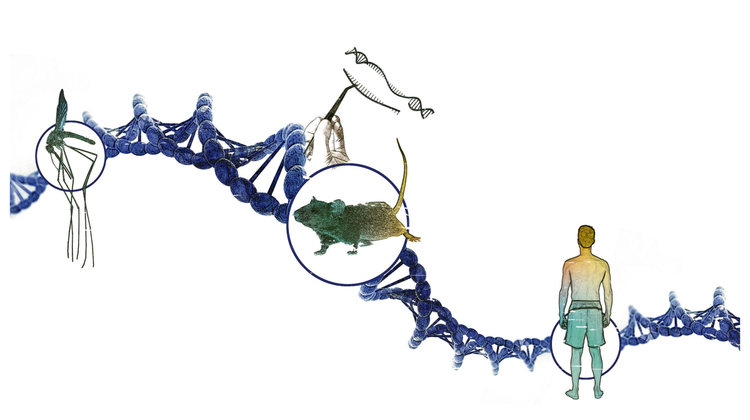
Wenn ein Gen die Vererbungswahrscheinlichkeit von 50 Prozent auf 55 Prozent erhöhen kann, ist das auf lange Sicht ein unglaublicher selektiver Vorteil. "Dieses Gen wird sich vollständig durchsetzen", sagt Burga, der dieses Phänomen an Fadenwürmern erforscht.
Die egoistischen DNA-Abschnitte sind noch in einer anderen Hinsicht außergewöhnlich: Sie haben keine vordergründige Funktion für den Organismus und nutzen sehr unterschiedliche Strategien, um sich bei der Vererbung vorzudrängen. Wissenschafter erkannten schnell das Potenzial dieser evolutionären Tricks. 2003 schlug der britische Biologe Austin Burt erstmals die Schaffung künstlicher Gene-Drives nach Vorbild der eigennützigen DNA vor.
Genetischer Durchbruch
In der Praxis gestaltete sich das jedoch schwierig – bis im Jahr 2012 ein anderes molekularbiologisches Werkzeug die wissenschaftliche Bühne betrat: die "Gen-Schere" CRISPR/Cas9, die es erlaubt, kostengünstig, schnell und vergleichsweise einfach Änderungen im Erbgut vorzunehmen. Die Methode hat die Genetik seither revolutioniert und auch die Entwicklung von Gene-Drives stark vorangebracht.
Die grundsätzliche Machbarkeit, eine ganze Insektenpopulation zum Aussterben zu bringen, wurde inzwischen schon gezeigt: Im Vorjahr veröffentlichten Forscher des Imperial College London im Fachblatt "Nature Biotechnology" eine Studie, in der sie erstmals eine Population der malariaübertragenden Moskitoart Anopheles gambiae binnen weniger Generationen im Labor zusammenbrechen ließen: Sie veränderten mithilfe von CRISPR/Cas9 einen Genabschnitt in 150 männlichen Insekten, der an der Ausdifferenzierung der Geschlechter beteiligt ist.
Vererbte Unfruchtbarkeit
Pflanzten sich die manipulierten Mücken nun mit normalen Artgenossen fort, entstanden in der Folge zwar fruchtbare Männchen, aber nur noch unfruchtbare Weibchen. In den Versuchsreihen wurden jeweils 300 normale Weibchen mit 150 normalen und 150 mutierten Männchen verpaart. Die männlichen Nachkommen der Mutanten vererbten die Gen-Veränderung so lange weiter, bis es schlicht keine fruchtbaren Weibchen mehr gab. Im Experiment dauerte das acht bis elf Moskito-Generationen, also gerade einmal ein paar Wochen.
Inzwischen bekunden sogar einige Ökologen Interesse an der Gen-Technologie: Sie könnte, so die Idee, im Kampf gegen invasive Arten eingesetzt werden. Vor allem auf Inseln werden eingeschleppte Spezies wie Ratten, Kaninchen oder Katzen immer wieder zur tödlichen Bedrohung für heimische Arten. Auf der britischen Überseeinsel Südgeorgien etwa hatten invasive Ratten, die dort keine natürlichen Feinde vorfanden, die einzigartigen Vogelbestände nahezu ausgerottet. Um das Schlimmste abzuwenden, brachten Behörden und Artenschützer tonnenweise Giftköder aus, an denen natürlich nicht nur Ratten zugrunde gingen. Wäre die Bekämpfung mittels Gene-Drive also umweltfreundlicher und sogar humaner gewesen?

Risiken und Nebenwirkungen
An ethischen und ökologischen Bedenken mangelt es nicht gerade: Die Freisetzung einer per Gene-Drive manipulierten Spezies in die Natur könnte völlig ungeahnte Folgen haben. Ihre Verbreitung lässt sich räumlich nicht beschränken – damit greift auch keine nationale Gesetzgebung. Was, wenn der Gene-Drive auf verwandte Arten überspringt und auch sie dezimiert? Welche Konsequenzen hat die Entfernung einer Spezies aus der Nahrungskette? Und ließe sich die Technologie als Biowaffe missbrauchen, indem etwa Mücken absichtlich mit gefährlichen Erregern ausgestattet werden?
Den vielen offenen Fragen und Unklarheiten stehen nicht nur rasante wissenschaftliche Fortschritte, sondern auch große rechtliche Unsicherheiten gegenüber. Erst im vergangenen November wurde ein Moratorium für Gene-Drives bei einem Treffen der UN-Biodiversitätskonvention mehrheitlich abgelehnt. Stattdessen sprachen sich die Teilnahmestaaten in einer vage formulierten Erklärung für die Notwendigkeit strenger Risikobewertungen aus und empfahlen, von Fall zu Fall zu entscheiden.
Modelle für die Medizin
Im Labor wurden Gene-Drives bisher in Hefe, Fruchtfliegen und zwei Moskitoarten getestet. Ende Jänner berichteten Forscher aus Kalifornien im Fachmagazin "Nature" vom nächsten großen Schritt: Sie verwendeten die Technologie erstmals in Säugetieren. Konkret manipulierten sie bei Mäusen eine für die Fellfarbe verantwortliche Genvariante so, dass diese häufiger vererbt wurde. Dabei hatten die Forscher freilich nicht die Bekämpfung von Mäusen vor Augen. Gene-Drives gelten auch als vielversprechende Werkzeuge für die medizinische Forschung: Sie könnten die Züchtung von Modellorganismen für bestimmte Krankheiten enorm erleichtern.

"Eine der wichtigsten Erkenntnisse der letzten Jahre ist, dass viele Erkrankungen wie Krebs, Alzheimer oder Diabetes durch die komplexe Interaktion einer Vielzahl von Genen ausgelöst werden", sagt der Molekularbiologe Burga. "Um das im Labor erforschen zu können, muss man all diese Mutationen in eine Maus einbringen – mit herkömmlichen Zuchtmethoden dauert das viele Jahre." Wenn man die gewünschten Genvarianten aber künstlich an eigennützige DNA-Elemente koppelt, ließe sich dieser Prozess drastisch verkürzen. (David Rennert, 15.2.2019)