Wien - "Wir haben in den letzten 50 bis 100 Jahren enorm viel gelernt - aber wir kennen auch viel noch nicht." Der Neurobiologe Simon Hippenmeyer weiß um die großen Lücken im Verständnis unseres Gehirns. Trotz der Arbeit von Tausenden von Wissenschaftern weltweit. Trotz relativ hoher Förderung, die vor allem mit Aussicht auf neue Therapien für psychiatrische oder degenerative Erkrankungen bereitgestellt werden. Dass nach wie vor so vieles im Dunkeln bleibt, hat auch mit der gewaltigen Anzahl von Nervenzellen - das menschliche Gehirn besteht aus schätzungsweise 100 Milliarden Neuronen - und ihren schier unendlichen Verknüpfungen zu tun.
Zwar sind die Forscher den Feinstrukturen des Sehens, Riechens, Tastens und anderer sensorischer Fähigkeiten auf der Spur. "Doch unsere höheren kognitiven Fähigkeiten wie etwa das Bewusstsein oder das Denken sind noch eine Black Box", sagt der Neurobiologe. Also jene Fähigkeiten, die uns zum Menschen machen. So verstehe man psychiatrische Erkrankungen wie etwa Autismus oder die Schizophrenie noch gar nicht. "Was wir bereits wissen: Sie entstehen höchstwahrscheinlich dann, wenn et- was in der Gehirnentwicklung schiefgeht." Hier setzt Hippenmeyer an: Er sucht nach den Prinzipien, die zu solchen Fehlern führen.
Größte Struktur des Gehirns
Der gebürtige Basler erforscht am Institute of Science and Technology (IST) Austria in Klosterneuburg die Entwicklung des Gehirns im Mausmodell, genauer den Aufbau der Großhirnrinde. Diese ist die größte Struktur des Säugetiergehirns, die sich wie ein Mantel um die anderen Bereiche legt und höhere Gehirnfunktionen wie Wahrnehmung, Kognition und Erinnerung steuert. "Kennt man einmal das Grundgerüst im Detail, kann man ziemlich sicher auch besser auf Funktionsweisen schließen - das ist zumindest mein Ansatz."
Wann und wie sich Stammzellen teilen, um Nervenzellen einer bestimmten Hirnregion zu bilden, konnte Hippenmeyer mit Kollegen bereits zeigen. Es ist kein Zufall, wie sich die Nervenzellen zu dem großen Verbund verknüpfen. Jedes Gehirn hat eine vorgegebene Architektur. "Die Mediziner erstellen nun Kataloge mutierter Gene, die bestimmte Krankheiten verursachen. Wir gehen weiter und wollen sehen, was diese Gene machen", sagt der 39-Jährige.
Fehler in der Erbinformation
Fehler in der Erbinformation, also Genmutationen, können an drei wichtigen Stellen der Gehirnentwicklung den Aufbau der Hirnarchitektur stören: bei der Bildung von Nervenzellen aus Stammzellen, bei der Wanderung der Zellen in das für sie bestimmte Territorium sowie bei der Verknüpfung der Nervenzellen. Die Fehler in der Erbinformation macht sich der Forscher zunutze, um die grundlegenden molekularen Mechanismen der Hirnentwicklung besser zu verstehen.
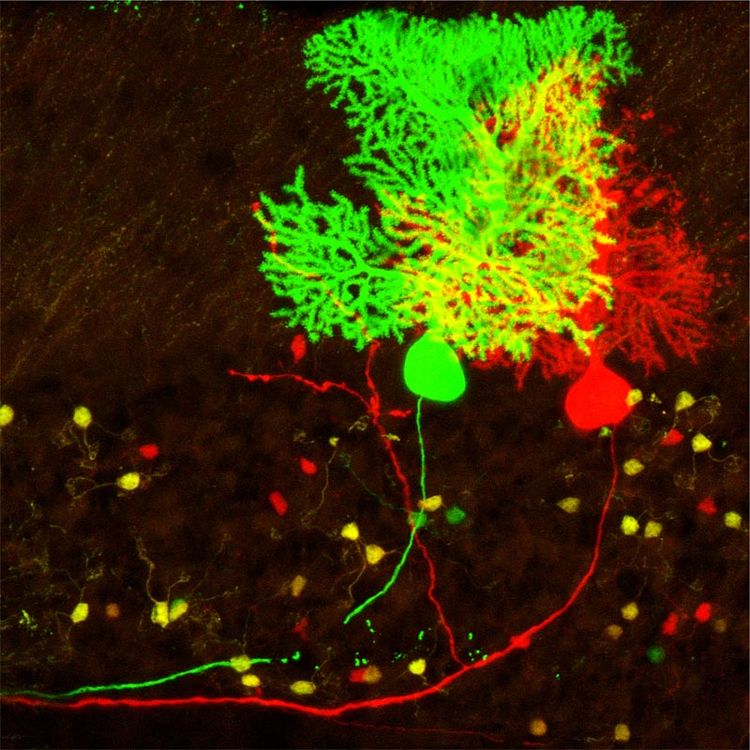
Zwei Beispiele: Die sogenannte Lissenzephalie ("glattes Gehirn") ist eine seltene Erkrankung, die bei Neugeborenen zu schweren Missbildungen führt, ausgelöst dadurch, dass die Nervenzellen nicht zu ihrem Bestimmungsort wandern konnten. Bei der Mikrozephalie ist das Gehirn kleiner als normalerweise, die Stammzellen haben weniger Nervenzellen gebildet. "In beiden Fällen kann eine einzige spontane Mutation dafür ausreichen, dass diese Erkrankungen entstehen", sagt Hippenmeyer. Was die Genmutationen auf Ebene der einzelnen Nervenzelle bewirken, konnte der Forscher mit einer speziellen Methode aufdecken: mithilfe der "Mosaic Analysis with Double Markers" (MADM).
Vor seinem Wechsel nach Österreich im Jahr 2012 verbrachte der Schweizer sechs Jahre an der Stanford University. Von MADM hatte er bereits in einem Fachartikel gelesen. Er bewarb sich erfolgreich um eine Postdoc-Stelle an der kalifornischen Elite-Uni, um die Technik für das Mausmodell weiterzuentwickeln. Sie versprach einen sehr tiefen Einblick in das Säugetiergehirn. Heute lassen sich mit ihr einzelne Nervenzellen grün und rot markieren, genetisch manipulieren und in vivo über das Fluoreszenzmikroskop beobachten. Somit können die Forscher auch gleichzeitig normale Zellen und Krankheitszellen vergleichen.
Bei der Fruchtfliege ist die Methode bereits seit Mitte der 1990er-Jahre im Einsatz. Die Anwendung auf Mäuse erwies sich indes als schwierig. "Die Zucht von Mäu- sen ist sehr aufwändig und komplex. Genetisch veränderte Mäuse herzustellen ist nicht so gut planbar. Das ist die Biologie! Wir hatten viel Glück, hier den richtigen Ansatz zu finden", sagt Hippenmeyer.
"Manchmal mussten wir einfach unseren besten Vermutungen folgen. Sicher waren wir nie", meint der Familienvater, der seit seinen Studien in Stanford auch zwei Patente als Co-Erfinder hält. "Vielleicht war ein gesunder naiver Wille dahinter, das zu versuchen. Es ist natürlich toll, wenn man dann Erfolg hat und die Methode funktioniert."
MADM kann bisher bei sechs der insgesamt 19 Maus-Chromosomen angewendet werden. Das schafft Zugang zu etwa 7000 Genen, inklusive vieler Krankheitsgene. Hippenmeyers Arbeit ist ein gutes Beispiel dafür, dass Grundlagenforschung sich nur bedingt in ein zeitliches Korsett zwängen lässt. "Vor zehn Jahren wurde der erste Fachartikel über MADM publiziert. Ich habe vier bis fünf Jahre gebraucht, um die Technik effizienter zu machen. Und wir stehen nach wie vor am Anfang: Bis wir die Analyse auf alle 19 Mauschromosomen anwenden können, braucht es wohl noch einmal fünf bis sechs Jahre."
Und bis man unser Gehirn wirklich verstehe, werde es wohl noch deutlich länger dauern, sagt Hippenmeyer. Trotz der Durchbrüche in manchen Feldern wie etwa der Stammzellenforschung. "Vor 15 Jahren hat man versprochen, es wird innerhalb der nächsten fünf Jahre effiziente Stammzelltherapien für Patienten mit Gehirnerkrankungen geben - das ist so nicht eingetreten. Effektive Therapien zu entwickeln braucht eben wie die Grundlagenforschung seine Zeit." (Lena Yadlapalli, DER STANDARD, 14.1.2015)