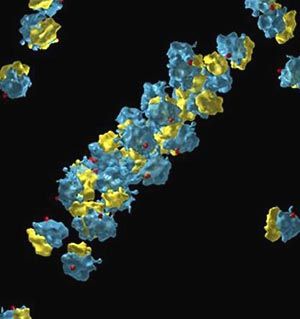
Dreidimensionale Rekonstruktion einer Proteinfabrik mittels Kryo-Elektronentomographie
München - Kürzlich ist es Wissenschaftlern am Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München gelungen, das Innenleben einer intakten menschlichen Zelle mittel Kryo-Elektronentomographie dreidimensional abzubilden. So konnten sie zeigen, wo sich die Ribosomen in der Zelle befinden und wie sie angeordnet sind. In der Vergangenheit war das nur bei Bakterienzellen möglich, gaben die Forscher bekannt. Die Ergebnisse wurden nun im Fachjournal "Molecular Cell" veröffentlicht. Sie tragen dazu bei, die Verteilung der zellulären Bestandteile und damit die räumliche Organisation der gesamten Zelle besser zu verstehen.
Hintergrund
Ribosomen sind als Proteinfabriken der Zelle für die Herstellung von Proteinen zuständig. Sie treten in der lebenden Zelle meist wie an einer Perlschnur aufgereiht in sogenannten Polyribosomen auf. Bislang konnten nur einzelne, isolierte Ribosomen betrachtet werden, weswegen die Proteinproduktion innerhalb der Zelle sowie die Einbindung der Ribosomen in die komplexen zellulären Strukturen und Prozesse nicht vollständig erfassbar wurden. Wie die Forscher nun bekannt gaben, ermöglicht die Kryo-Elektronentomographie nun, die Ribosomen in ihrer "natürlichen Umgebung", dem Zellinneren, abzubilden und zu untersuchen.
Die Methode
Und so funktioniert die Technik: Die Zelle wird quasi schockgefroren, sodass ihre räumliche Struktur erhalten bleibt und sie in ihren Eigenschaften nicht verändert wird. Dann nehmen die Forscher mit dem Elektronenmikroskop aus verschiedenen Blickwinkeln zweidimensionale Bilder der Zelle auf, aus denen sie schließlich ein dreidimensionales Bild rekonstruieren. Die nun erstmals erfolgte dreidimensionale Abbildung einer intakten menschlichen Zelle sei die Fortsetzung früherer Arbeiten, in denen dem Team um Wolfgang Baumeister und F.-Ulrich Hartl bereits die räumliche Analyse von Polyribosomen des Bakteriums E. coli und von inaktivierten Ribosomen in einer ganzen E. coli-Zelle gelungen sei, gab das Forschungsteam bekannt.
Die Forscher fanden nun heraus, dass die Anordnung der Ribosomen dafür sorgt, dass neu entstandene, noch ungefaltete Proteine großen Abstand voneinander einhalten. "Wir konnten eine ähnliche Positionierung schon bei bakteriellen Zellen beobachten, was darauf schließen lässt, dass die Ribosomen bei allen Lebewesen auf nahezu gleiche Weise angeordnet sind", erklärt Florian Brandt, Wissenschaftler am MPIB. "Diese räumliche Organisation der Ribosomen könnte darauf ausgerichtet sein, ein Verklumpen und eine daraus resultierende Fehlfaltung neu entstandener Proteine zu verhindern." In Zukunft könnte interessant sein, "wie sich diese Organisation zum Beispiel in alternden und kranken Zellen ändert und welchen Einfluss das auf die Gesamteffizienz der Proteinproduktion und -faltung haben könnte", so Brandt. (red)