New York / Wien – Es gibt kaum einen Wissenschafter, der sich mit der Struktur von Molekülen beschäftigt, der sie nicht nutzt: Kryoelektronenmikroskopie, kurz Kryo-EM. Diese Technologie, die in den vergangenen fünf Jahren richtig zum Durchbruch kam, erlaubt es, die dreidimensionale Struktur von Molekülen zu bestimmen, in einer Weise, wie dies zuvor nicht möglich war. Dadurch können etwa neue Einsichten in Proteine, Ribosomen und die Erbsubstanz gewonnen werden.
Bisher wurde zur Bestimmung von Molekülstrukturen die sogenannte Röntgenstrukturanalyse eingesetzt. Dabei müssen Kristalle gezüchtet werden, durch die Bestrahlung mit Röntgenstrahlen ist ein Rückschluss auf die Struktur möglich. Das Züchten von Kristallen ist aber mitunter recht aufwendig und für eine größere Anzahl von Molekülen nicht möglich. Außerdem entspricht die Struktur nicht unbedingt jener, wie sie tatsächlich vorkommt. Mit der Kryo-EM können hingegen die natürlichen Funktionen eines Moleküls beobachtet werden. Dabei werden Proteinkomplexe auf bis -260 °C abgekühlt und aus verschiedenen Winkeln fotografiert sowie die Bilder zusammengesetzt.
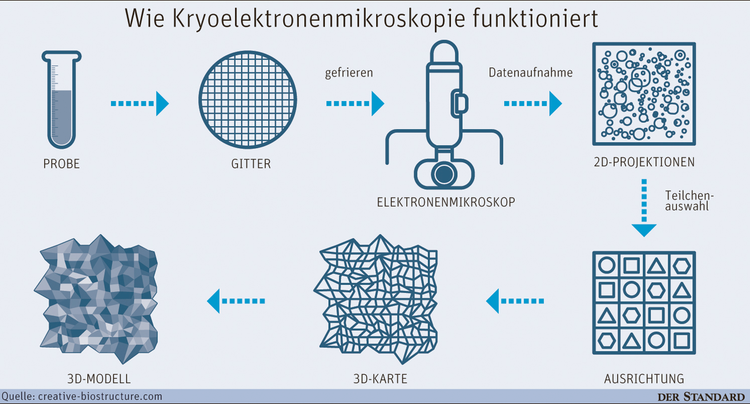
2015 wurde die Methode vom Fachmagazin "Nature" als "Method of the Year" gekürt, heuer bekamen drei der Pioniere von Kryo-EM, Joachim Frank, Richard Henderson und Marin van Heel, den Wiley-Preis zugesprochen. Sechs Mal durften sich Wiley-Laureaten später über den Nobelpreis freuen – so gelten die Wegbereiter von Kryo-EM als aussichtsreiche Kandidaten für die höchste wissenschaftliche Auszeichnung, die nächste Woche verlautbart wird.*
STANDARD: Sie waren an der Entwicklung von Kryoelektronenmikroskopie beteiligt - wie kam das?
Frank: In den 1960ern wurde an dreidimensionalen Strukturen von Makromolekülen mittels Elektronenmikroskopie gearbeitet. Ich machte zu dieser Zeit meine Dissertation am Max-Planck-Institut für Biochemie in München bei Walter Hoppe, der ein Experte in der Röntgenstrukturanalyse war und damals begann, im Bereich Elektronenmikroskopie zu arbeiten. Er hatte die Idee, einzelne Moleküle anzusehen und wurde zu einem Pionier von Elektronentomografie. Dabei muss man die Struktur in viele Richtungen kippen, um mehrere Perspektiven zu bekommen. Problematisch dabei ist, dass ein Molekül, wenn es so häufig exponiert wird, unter dem Elektronenstrahl verbrennt. Man bekommt also eine Struktur, aber wegen des Strahlenschadens ist sie völlig bedeutungslos.

STANDARD: Wie kann man den Strahlenschaden umgehen?
Frank: Eine Möglichkeit ist, mit Symmetrien zu arbeiten, dann kann man bereits aus einer Ansicht vielfältige Informationen gewinnen.
STANDARD: Welche Idee brachten Sie ins Spiel?
Frank: Als ich am Cavendish Lab in Cambridge arbeitete, habe ich die Idee entwickelt, das Molekül nicht zu kippen, sondern von der Tatsache Gebrauch zu machen, dass das Molekül in einer Probe in vielen Kopien existiert. Unter dem Mikroskop sind sie alle zufällig orientiert – Millionen von einzelnen Molekülen, die alle eine idente Struktur haben. Wenn man mehrere Aufnahmen macht, bekommt man Millionen verschiedene Perspektiven eines Moleküls. Das einzige Problem ist, dass man herausfinden muss, wie die Moleküle jeweils orientiert sind. Das lässt sich nachträglich durch computergestützte, mathematische Prozeduren herausfinden.
STANDARD: Wie hat die Fachwelt auf Ihren Vorschlag reagiert?
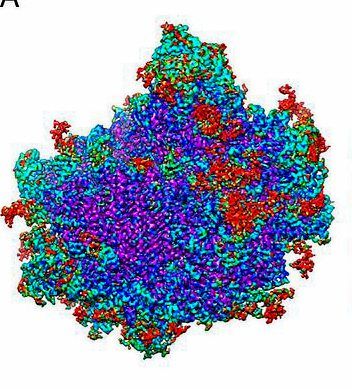
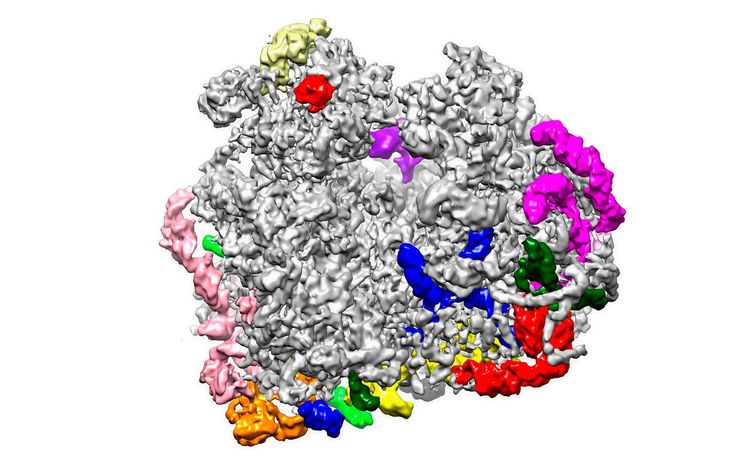
Frank: Als ich die Idee präsentierte, sagten die Leute zunächst, dass ich verrückt sei und dass das nie funktionieren würde. Ich arbeitete dennoch an der Software und den mathematischen Prozeduren, und über die Jahre hinweg erreichte ich einen stetigen Fortschritt dabei. Das erste wichtige Resultat einer 3D-Rekonstruktion wurde 1985 publiziert – das war eine Struktur des Ribosoms (ein großer molekularer Komplex, der Proteine synthetisiert, Anm.). 1990 ist die erste Kryoelektronenmikroskopie-Einteilchen-Rekonstruktion erschienen – ebenfalls des Ribosoms. Dieses war ein sehr gutes Molekül, um die Methode zu entwickeln, denn es ist ausreichend groß, hat einen guten Kontrast, und gleichzeitig wusste man nichts über seine Struktur. So war es eine einmalige Chance, mit der Methode, die ich entwickelt hatte, einen Durchbruch zu erzielen.
STANDARD: Wie ist das geschehen?
Frank: Der Durchbruch kam 1995 mit einem Paper, das wir in "Nature" publizierten, das das Ribosom zum ersten Mal in vielen Details gezeigt hat. Es war nur eine 25-Ångström-Auflösung, aber man konnte sehen, wie die Bestandteile zusammengefügt waren. Langsam arbeiteten auch andere Gruppen an der Technologie. Das Hindernis für höhere Auflösungen bestand in der Tatsache, dass Film damals das einzige Aufzeichnungsmedium war. Als Film in den 1990er-Jahren zum ersten Mal durch eine Digitalkamera ersetzt wurde, war das zunächst ein Schritt vorwärts, was die Automatisierung betrifft, aber ein Schritt zurück, was die Qualität angeht. In den frühen Nullerjahren wurden schließlich Kameras entwickelt, die die Aufnahme einzelner Elektronen ermöglichen. Seit 2012 sind sie kommerziell erhältlich. Die fünf Jahre danach waren einfach unglaublich. Denn nun ist die Technik, die ich langsam und beharrlich über lange Jahre entwickelt habe, plötzlich das "thing to do" geworden, sie greift um sich wie wildes Feuer. Jeder will das machen. Die Auflösung liegt nun bei zwei Ångström.
STANDARD: Sie haben Ihre akademische Karriere im Nachkriegsdeutschland begonnen. Wie hat sich die akademische Kultur seither geändert?
Frank: Es hat immer einen sehr großen Unterschied gegeben, wie Wissenschaft in Europa und in Amerika betrieben worden ist. Die USA sind charakterisiert durch eine größere Offenheit und viel mehr Inklusion der jüngeren Menschen, bis hin zu den Studenten. In Deutschland war es damals so, dass es immer einen gab, der an der Spitze stand und als Autorität eine ehrliche Diskussion unterdrückte. Das habe ich damals sehr stark gespürt und bin deswegen in viele Streitereien mit meinem Betreuer geraten.
STANDARD: Neben Ihrer wissenschaftlichen Arbeit schreiben Sie auch fiktionale Texte. Was bedeutet Schreiben für Sie?
Frank: Es geht mir dabei darum, Balance zu halten in meinem Leben. Ohne das Schreiben würde ich mich sehr abgeschieden fühlen. Die Welt ist ein unglaublicher schöner und komplexer Ort, und die Wissenschaft ist so ein begrenzter Zugang dazu. Auch hat die Wissenschaft sehr strenge Regeln, durch die Gefühle draußen gehalten werden. Ich würde nicht erlauben, dass Gefühle die Wissenschaft unterwandern, daher habe ich mich entschieden, mein Leben auszubalancieren, indem ich auch völlig andere Dinge tue wie fotografieren und fiktionale Texte schreiben.
STANDARD: Was sind die Themen, denen Sie sich in Ihren Geschichten widmen?
Frank: Meine längeren Texte haben unausweichlich immer mit der Existenz eines Wissenschafters zu tun und mit einer Welt, die schwer zu verstehen ist. In meinen Kurzgeschichten geht es um sehr verschiedene Themen. In einigen Geschichten verwende ich Material von früheren Generationen meiner eigenen Familie. Die Kurzgeschichte "A Timely Death" hat etwa mit der Mutter von Wolfgang von Goethe zu tun. Sie ging im Haus der Vorfahren meiner Mutter in Frankfurt ein und aus. Eines Tages sagte sie im Hinausgehen, dass sie in zwei Tagen sterben werde. Und so geschah es dann auch. (Tanja Traxler, 1.10.2017)