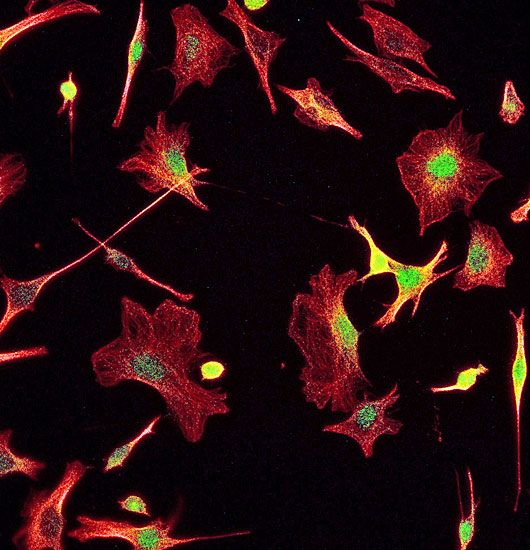
Bindegewebszellen einer Maus. Rote Färbung: Cytoskelett. Grüne/gelbe Färbung: Von ATMIN verändertes Protein CRMP2, das bei Alzheimer verändert wird.
Wien – Die funktionierende Arbeit des Kinase-Enzyms ATM sowie dessen Ko-Faktors ATMIN ist notwendig, damit es bei der Zellteilung nicht zu gefährlichen Veränderungen der DNA kommt. Wissenschafter um Joanna Loizou vom Forschungszentrum für Molekulare Medizin (CeMM) der Akademie der Wissenschaften (ÖAW) in Wien haben die Funktion dieser Proteine nun geklärt und in "Cell Reports" veröffentlicht.
Zellen müssen für die Teilung zunächst ihr komplettes Erbgut verdoppeln. Dabei werden beispielsweise beim Menschen rund drei Milliarden genetischer Buchstaben kopiert, was immer wieder zu Schäden an der DNA führt. Damit die Doppelhelix der DNA kopiert werden kann, wird ihre verdrehte Strickleiterstruktur zunächst entwunden und anschließend an den Sprossen aufgeschnitten. Beide Einzelstränge werden schließlich durch einen neu hergestellten, gegenüberliegenden Strang ergänzt – das Resultat sind zwei neue, vollständig identische Doppelstränge. Das ist ein Stressfaktor für die Zellen und auch eine potenzielle Fehlerquelle.
Gefährlicher Zellstress
Loizou konnte mit Kollegen aus Deutschland, Großbritannien und den USA bisher unbekannte Mechanismen aufklären, welche die Zellen vor Schäden schützen. "Das Aufspalten der DNA in zwei Einzelstränge – die Bildung der sogenannten 'Replikationsgabel' – gerät häufig ins Stocken", so die Forscherin. "In dieser Phase ist die DNA besonders empfindlich und kann leicht brechen, für die Zelle bedeutet das Stress. Eine ganze Reihe an Mechanismen steht deshalb parat, um eventuelle Schäden möglichst schnell zu reparieren." Unzählige verschiedener Moleküle sind an solchen Reparaturen beteiligt, doch gesteuert werden sie nur von wenigen Enzym-Proteinen, sogenannten "Kinasen".
Eine dieser Kinasen haben die Wissenschafter in ihrer Arbeit genauer unter die Lupe genommen: ATM, ein Enzym, das eigentlich für andere DNA-Reparaturprozesse bekannt ist. Vorangegangene Experimente zeigten bereits, dass ATM auch während der Zellteilung eine entscheidende Rolle spielt. Das nahmen die Forscher zum Anlass, in einer groß angelegten Studie die genauen Reaktionswege von ATM und seinem Aktivierungsprotein, ATMIN, nachzuzeichnen.
Pharmakologisches Interesse
Für ihre Studie verglichen sie den vollständigen RNA-Satz – und damit die Genaktivität – als auch alle Proteine aus mutierten Zellen, denen das Gen für ATM oder dessen Aktivierungsprotein ATMIN fehlte, mit RNA und Proteinen von normalen Zellen. Dabei stellte sich heraus, dass ATM und ATMIN die Erbsubstanz an bestimmten Stellen "phosphorylieren", das heißt, dass sie an die DNA Phosphate anhängen. Dies führt in der Zellbiologie zumeist zur Aktivierung von Genen und zur Bereitstellung der notwendigen Energie.
Die Arbeiten erfolgten durch sogenannte Hochdurchsatzanalysen. "Mit diesen großen, vollständigen Datensätzen konnten wir die Funktionsweise von ATM sehr unverfälscht untersuchen, das war ein großer Vorteil für unsere Arbeit", sagte Loizou.
Die Ergebnisse könnten für die Krebs- und Alzheimerforschung interessant sein. Krebszellen teilen sich extrem schnell und sind daher besonders auf die Reparaturmechanismen angewiesen – das macht die Reaktionspartner von ATM und ATMIN möglicherweise zu Angriffspunkten für Arzneimittel. "Wir haben auch herausgefunden, dass durch ATMIN ein Protein (CRMP2) chemisch auf die gleiche Art verändert wird, wie wir es auch in den Nervenzellen von Alzheimerpatienten beobachten", sagte Loizou. Diese Mechanismen könnten demnach auch auf dem Gebiet der neurodegenerativen Erkrankungen von Bedeutung sein. (APA, 16.4.2016)