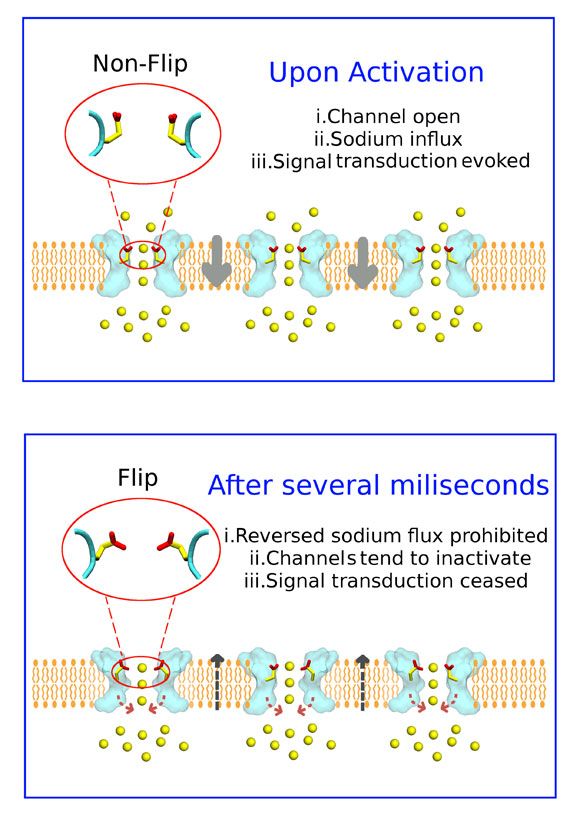
Schematische Darstellung des Natriumionenkanals (hellblau). Oben: Einstrom von Natriumionen (gelb gefärbt). Unten: Konformationsänderung von E53 während des Ionenausstroms.
Wien - Zellen grenzen sich von der Umgebung durch eine Membran ab. Um ihre Funktionen aufrecht zu halten und Signale weiterzuleiten, gibt es in der Membran spezielle Proteine, sogenannte Ionenkanäle. Durch diese können bis zu 100 Mio. Ionen pro Sekunde in die Zelle strömen oder herausgepumpt werden - ein Vorgang, den Wiener Forscher nun in Computersimulationen erstmals detailliert beobachten konnten.
Anna Stary-Weinzinger, Pharmakologin an der Universität Wien, erforscht seit Jahren diese Ionenkanäle, durch die Kalium-, Natrium- oder Kalziumionen geleitet werden. Diese Membranproteine sind nicht nur für eine Vielzahl von Prozessen im menschlichen Körper lebenswichtig, sie sind auch wichtige Angriffspunkte zahlreicher Medikamente. Zehn Prozent der eingesetzten Arzneimittel erzielen ihre Wirkung durch Interaktion mit diesen Zellstrukturen. Die Erforschung dieser Proteine ist deshalb auch für Entwicklung neuer Medikamente wichtig.
Im Mittelpunkt der neuen Arbeit, die nun im Fachjournal "PLOS Computational Biology" erschienen ist, steht der Ionenfluss durch spannungsgesteuerte Natriumionenkanäle. Ohne diese könnten zentrale Funktionen wie der Herzschlag, die Signalweiterleitung im Gehirn oder Muskelbewegungen nicht stattfinden.
Modellrechnung per Supercomputer
Mithilfe des leistungsstärksten Computers Österreichs, des Vienna Scientific Cluster (VSC), führten die Forscher sogenannte Moleküldynamiksimulationen durch und konnten dabei den Proteinen quasi bei der Arbeit zusehen. Es zeigte sich, dass Ionen deutlich schneller in die Zelle hineinströmen als hinaus. "Den Schlüssel dafür liefert eine negativ geladene Aminosäure: Glutaminsäure 53, kurz E53", erklärt Stary-Weinzinger. Die Aminosäure kann je nach Ionenflussrichtung ihre räumliche Struktur - genannt "Konformation" - und damit die Geschwindigkeit des Ionenflusses ändern.
Die Forscher halten es für wahrscheinlich, dass diese Änderung der "Konformation" auch eine wichtige Rolle bei der sogenannten "Inaktivierung" spielt. Dabei handelt es sich um jenen Mechanismus, der den Ionenfluss kontrolliert stoppt, um die Signalweiterleitung zu unterbrechen. (APA/red, derStandard.at, 1.9.2014)