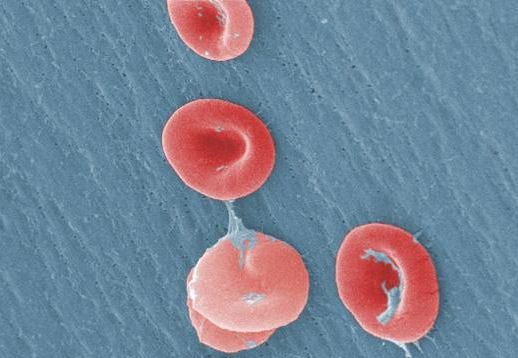
Das Rasterkraft- oder Atomkraftmikroskop soll in Zukunft biologisches Material wie Blutzellen noch genauer als bisher ertasten können. Der Sensor des Geräts fährt schon jetzt die Probe Punkt für Punkt ab, eine spezielle Nadel berührt dabei die Probenoberfläche.
"Es ist fair zu sagen, dass wir genauso wenig mit einzelnen Teilchen experimentieren, wie wir auch keine Ichthyosaurier im Zoo züchten können." Das schrieb der österreichische Physiker Erwin Schrödinger im Jahr 1952. "Er hat sich nicht vorstellen können, dass man einzelne Moleküle einmal sichtbar machen kann", erzählt der Biophysiker Peter Hinterdorfer.
Ein derartiges Unterfangen mag damals als Utopie gegolten haben. Doch schon der US-Physiker Richard Feynman ahnte, dass das Limit noch lange nicht erreicht war: 1959 sprach er in einem berühmt gewordenen Vortrag davon, dass "unten noch viel Raum" sei ("There's plenty of room at the bottom"). Er präsentierte darin wegweisende Gedanken zur später entwickelten Nanotechnologie und sprach auch über künftige Möglichkeiten, die Welt in einer höheren Auflösung darstellen zu können. Und tatsächlich: Seit rund drei Jahrzehnten ist die Erkennung von einzelnen Teilchen Realität. Heute kann man bereits Prozesse der Quantenphysik visualisieren, "die theoretisch vorhergesagt wurden", sagt Hinterdorfer.
Einzelne Atome lassen sich mit dem sogenannten Rasterkraftmikroskop - auch Atomkraftmikroskop genannt - auflösen. Mit ihnen kann man auch in subatomare Dimensionen vordringen. Etwa Elektronenwolken in der Festkörper- und Halbleiterphysik beobachten. In der Biologie lassen diese Geräte hingegen keine atomare Auflösung zu. "Hier haben wir es mit weicher und beweglicher Materie zu tun", erläutert der Linzer Forscher. So muss man sich hier auf die Oberflächenanalyse von Zellen und das Erkennen von Biomolekülen, z. B. Proteine, und submolekularen Strukturen beschränken.
Eierlegende Wollmilchsau
Das von Hinterdorfer geleitete Christian-Doppler-Labor für nanoskopische Methoden in der Biophysik an der Uni Linz arbeitet an der Weiterentwicklung der Mikroskope: Sie sollen künftig möglichst viele Eigenschaften der Probe erfassen können. "In Deutschland würde man von der eierlegenden Wollmilchsau sprechen", lacht der Biophysiker. Die Entwicklung erfolgt in Zusammenarbeit mit zwei Unternehmen im Bereich Sensor- und Analysetechnik (Agilent und SCL), die das Labor zur Hälfte finanzieren. Die andere Hälfte tragen Wirtschaftsministerium und Nationalstiftung.
Die Forscher wollen Oberflächenstrukturen von biologischer Materie wie Zellen, Membranen und Viren erfassen. "Die Zellen sind im Vergleich zu Atomen recht groß. Ihre Zellgröße beträgt im Schnitt zehn Mikrometer. Wir versuchen, Details auf der Zelle herauszufinden", so der Laborleiter. Dabei kann das Rasterkraftmikroskop - im Gegensatz zu optischen Verfahren - nicht im eigentlichen Sinne sehen.
Es "fühlt" vielmehr. Der Sensor des Gerätes fährt die Probe Punkt für Punkt ab, die spezielle Nadel berührt die Probenoberfläche. So wird das Relief der Zelloberfläche abgebildet. Es entsteht quasi "das topografische Landschaftsbild mit den Tälern und Bergen der Zelle", so Hinterdorfer. Darauf aufbauend haben die Linzer Forscher Anwendungen entwickelt, die Wechselwirkungen zwischen einzelnen Molekülen messen können.
Die Messsonde wird mittels Chemie zu einem Sensor aufgerüstet. "Wir hängen der Sonde sogenannte Liganden an", erläutert der Forscher. Das sind bestimmte Stoffe wie Antikörper oder Pharmaka, die an bestimmte Rezeptoren auf der Zelloberfläche binden können und so gewisse zelluläre Prozesse initiieren. Rezeptoren sind etwa "Membrantransporter", die spezifische Moleküle über die Zellmembran in die Zelle transportieren, oder immunologisch relevante Proteine. "Das ermöglicht zu überprüfen, wie gut Pharmaka an Rezeptoren binden. Oder überhaupt herausfinden, wo Rezeptoren in der Zelle sitzen."
Lebende Bedingungen
Der Vorteil der Rasterkraftmikroskopie ist, dass man die Zellen und Moleküle unter lebenden Bedingungen studieren kann. Auch wenn die Sensornadel die Zelle berührt, "wird diese nur ein bisschen deformiert, aber nicht zerstört", sagt Hinterdorfer. Auch mechanische Eigenschaften der Zellen lassen sich erheben. So haben die Forscher bereits nachgewiesen, dass Krebszellen weicher als normale Zellen sind - und so bei der Tumorausbildung einfacher in Gewebe einwandern können.
Ein weiterer Ansatz des Labors ist die Kombination verschiedener Methoden. So wurde die Rasterkraft- mit der Fluoreszenzmikroskopie verbunden; eine entsprechende Anwendung wird bereits vertrieben. "Die Fluoreszenzmikroskopie hat als ein optisches Verfahren zwar eine geringere Auflösung, aber man sieht mit ihr in Zellen hinein", beschreibt Hinterdorfer den zusätzlichen Nutzen.
Ein Fluoreszenzmikroskop zählt heute wohl in Laboren zum Standardinventar. Die Methode ist älter als die Rasterkraftmikroskopie. Sie hat laut dem Forscher bereits breiteren Eintritt in die Biologie gefunden. Die Rasterkraftmikroskope müssten noch eher von Spezialisten wie Biophysikern betrieben werden.
Aber das wird sich wohl über kurz oder lang mit den weiteren Fortschritten auf dem Gebiet ändern - und mit "Durchbrüchen" wie der Entwicklung der "High-Speed-Atomkraftmikroskopie" vor einigen Jahren. Der Clou dabei: Das Rasterkraftmikroskop tastet die Probe zeilenweise ab. "Mit einem konventionellen Gerät braucht man bis zu einer Minute für ein 100 mal 100 Mikrometer großes Bild. Mit den High-Speed-Geräten können die Bilder bereits in 20 Millisekunden aufgenommen werden."
Damit lassen sich nun auch biologische Prozesse abbilden, "die sich in der Regel in Zeitfenstern von zehn bis 100 Millisekunden abspielen." Und die Grenzen der Auflösung sind für Hinterdorfer auch hier noch nicht erreicht. (Lena Yadlapalli, DER STANDARD, 18.9.2013)