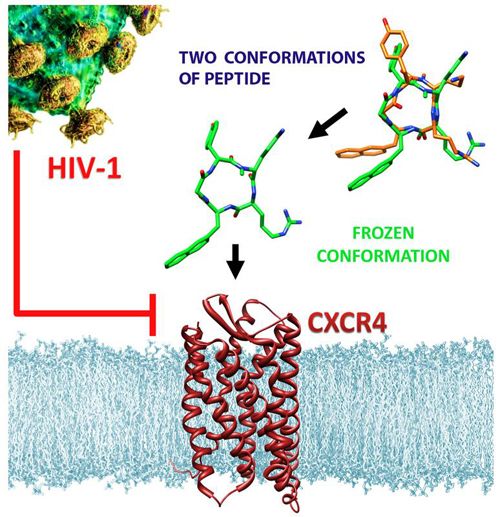
Das abgewandelte anti-HIV-Molekül (Mitte) bindet mit hoher Affinität an den CXCR4-Rezeptor auf der Oberfläche von Immunzellen.
Im Kampf gegen AIDS haben Wissenschaftler einen neuen viel versprechenden Therapieansatz gefunden - mit denkbar einfachen Mitteln. Obwohl sie die Form eines bereits bekannten synthetischen Anti-HIV-Moleküls nur leicht veränderten, erzielten sie eine große Wirkung: Das neue Mini-Protein dockt besser an CXCR4-Rezeptoren auf der Oberfläche von Immunzellen an, einem bevorzugten Angriffspunkt für häufig vorkommende HIV-Varianten.
Damit ist dem Aids-Erreger der Eintritt in die Zellen verwehrt, die Viren können sich nicht weiter im Organismus ausbreiten. Diese Resultate wurden kürzlich in der internationalen Ausgabe des Fachmagazins "Angewandte Chemie" veröffentlicht.
Interessanter Wirkstoff-Kandidat gegen HIV und AIDS
Die unterschiedlichen Erreger des HIV-1-Virenstammes verschaffen sich Zugang zu den Immunzellen, indem sie an die Zell-Rezeptoren CCR5 oder CXCR4 andocken. An diese Bindungsstellen heften sich üblicherweise körpereigene Botenstoffe, so genannte Chemokine. Während es bereits ein CCR5-spezifisches HIV-Medikament gibt, ist für CXCR4 bisher kein Arzneimittel zugelassen. Da das neue, ringförmige Peptid - ein Mini-Protein - den CXCR4-Rezeptor für das Virus blockiert, könnte es sich als ein interessanter Wirkstoff-Kandidat gegen HIV und AIDS erweisen.
"Das Molekül könnte eine wirksame Waffe gegen besonders aggressive HIV-1-Stämme sein. Diese Viren finden wir häufig bei Patienten, die seit langer Zeit HIV-infiziert sind", erklärt Ruth Brack-Werner, Virologin am Helmholtz Zentrum München.
Das Forschungsprojekt wurde von Wissenschaftlern vom Lehrstuhl für Pharmazeutische Radiochemie und am Institute for Advanced Study der TUM initiiert und gemeinsam mit Molekularbiologen der Universität Neapel und Virologen des Helmholtz Zentrum München durchgeführt.
Die TUM-Wissenschaftler um Hans-Jürgen Wester und Horst Kessler hatten ursprünglich an einem neuen Bildgebungs-Verfahren für Tumore gearbeitet. Dafür nutzten sie ringförmige Proteinschnipsel, die sie veränderten, um ihre spezifische Bindung an den CXCR4-Rezeptor zu erhöhen. Dabei erkannten sie, dass diese Methode auch ein enormes Potenzial für die Arzneimittelforschung birgt.
Geringe Strukturveränderung, große Wirkung
Die Wissenschaftler bauten das Peptid mit einem einfachen Trick um: Sie verschoben eine Aminosäuren-Seitenkette von Kohlenstoff zu einem benachbarten Stickstoff-Atom. So veränderten sie die Grundstruktur des Moleküls zwar nur geringfügig - seine biologischen Eigenschaften dafür umso mehr: Die Bindungsgruppen des Peptids befinden sich jetzt in einer optimalen Stellung, um an den CXCR4-Rezeptor anzudocken. Damit bindet das Peptid 400- bis 1.500-mal besser an CXCR4 als bisher bekannte andere Verbindungen, die derzeit als Wirkstoffe getestet werden.
Zudem weist das künstliche Peptid Merkmale auf, die seinen Einsatz im Organismus begünstigen. Sein besonderer chemischer Aufbau schützt das ringförmige Molekül vor der Zerstörung durch körpereigene Enzyme. Da CXCR4-Rezeptoren auch eine wichtige Rolle bei der Entstehung von Krebsmetastasen spielen, benutzen die Münchner Forscher eine abgewandelte Form dieses Moleküls bereits für die Bildgebung von Tumoren. (red, derStandard.at, 9.8.2012)